QU’EST-CE QUE L’ÉPILEPSIE ?
Le terme “épilepsie” vient du grec et signifie “prendre par surprise”.Il faut bien distinguer une crise d’épilepsie isolée - qui peut avoir de multiples causes -pouvant survenir chez environ 5% de la population, une fois dans la vie et la maladie neurologique, d’origine cérébrale, comprenant toutes les formes d’épilepsies avec des crises qui se répètent.Les épilepsies représentent la maladie neurologique la plus fréquente après la migraine.Dans le monde, près de quarante millions de personnes sont touchées par l’épilepsie.Médicalement, l’épilepsie est une pathologie relativement bénigne dans 75% des cas ; mais, même dans ces conditions, le retentissement psychologique, familial et social est bien supérieur à la gravité réelle de la maladie. Seule une meilleure information des patients, de leur famille et du public peut aider à atténuer les craintes et les préjugés qu’entraînent trop souvent des manifestations parfois spectaculaires de cette maladiequi - il faut le souligner - n’est pas une maladie mentale, même s’il peut exister dans certains cas des troubles du comportement associés.
COMMENT SE PRODUISENT LES CRISES D’ÉPILEPSIE ?
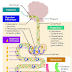
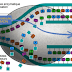
Pour que surviennent des crises d’épilepsie, il faut que de nombreuses cellules nerveuses (des neurones), “déchargent” en même temps et de façon anormale, cette décharge étant le résultat d’un dysfonctionnement au niveau de la membrane qui entoure la cellule nerveuse. Normalement, cette membrane contribue, entre l’intérieur de la cellule et le milieu extérieur, aux échanges des différents ions (sodium, potassium, calcium...) par l’intermédiaire de minuscules canaux “ioniques’. Ces derniers sont sous la dépendance de substances appelées neurotransmetteurs qui peuvent être soit excitateurs (tel le glutamate), soit inhibiteurs (tel le GABA ou acide gamma aminobutyrique).Dans l’épilepsie, l’hypothèse d’un déséquilibre entre mécanismes inhibiteurs et excitateurs expliquerait la mise en jeu d’une activité neuronale intense et désordonnée. Des phénomènes complexes de “recrutement” des neurones entraîneraient une réaction en chaîne et une propagation de la décharge. Il s’agit là d’un simple aperçu schématique et incomplet.
POURQUOI LES CRISES SONT-ELLES DIFFÉRENTES ?
Les crises se manifestent de façon très variable, en relation avec la zone du cerveau d’où part la décharge et son mode de propagation.Par exemple, une crise partielle localisée dans le lobe occipital, se traduira par une perception visuelle anormale ; et si elle se propage vers l’avant, elle pourra entraîner des phénomènes moteurs ou sensitifs. Si elle diffuse à l’ensemble du cerveau, elle pourra se transformer en crise généralisée tonico-clonique (ex : grand mal).Une crise est un phénomène très dynamique qui met enjeu, de façon successive, diverses structures cérébrales et, par voie de conséquence, leurs fonctions (langage, phénomènes moteurs ou sensitifs, mouvements oculaires, etc.) mais de façon anormale. Le point de départ initial de la décharge intéresse une zone très localisée dite “zone épileptogène”, dont les premiers signes cliniques auront une valeur très localisatrice et dont le médecin demande habituellement la description ; elle guidera son choix thérapeutique. Habituellement, mais pas toujours, la décharge suivra le même cheminement, donc les signes seront les mêmes, pour une personne donnée.L’épilepsie est une maladie complexe et il faut distinguer les crises qui en sont le symptôme principal et les épilepsies. Quand les crises prennent leur origine dans une zone localisée du cerveau, elles sont appelées partielles ; quand elles viennent de la totalité du cerveau, elles sont dites généralisées.
COMMENT SE PRESENTENT LES CRISES ?
est impossible de les décrire toutes car elles diffèrent les unes des autres. Elles sont aussi produites par des mécanismes différents. En effet, il existe des crises convulsives et d’autres qui ne le sont pas. Elles peuvent être partielles ou généralisées, elles peuvent - ou non s’accompagner de perte de connaissance, elles peuvent être uniquement motrices, ou sensorielles et survenir en pleine conscience.Ce qui est important, pour le diagnostic et pour le traitement, c’est que la personne atteinte, ou son entourage, puisse donner une bonne description des crises et de leur déroulement, car c’est cela qui va permettre de reconnaître les différents types de crises. La crise “grand mal” est la plus connue, parce que la plus spectaculaire cri, chute, perte de connaissance, convulsions toniques et cloniques, bave, apnée, parfois perte d’urine ou des selles... C’est une crise tonico-clonique généralisée. Ce n’est ni la plus fréquente, ni la plus grave. Elle risque d’entraîner des blessures et s’arrête seule au bout d’une minute environ. Le terme “absence” fait moins peur; il est souvent employé pour désigner toutes sortes
de crises peu visibles, sans convulsions, quelle que soit leur origine. En réalité, l’absence est un type de crise généralisée comportant une brève suspension de conscience, le regard devenant vide, la communication étant coupée pendant quelques secondes entre le sujet et son entourage. Elles sont habituellement répétées dans la journée et correspondent à ce que l’on appelait autrefois “le petit mal”.D’autres crises comportent une modification de la conscience, mais avec des comportements involontaires “automatiques” gestes bizarres, déambulation, paroles incompréhensibles.., dont le sujet ne se rend pas compte et qui peuvent le faire passer pour “fou” ou dangereux pendant quelques instants. Ce sont des “crises partielles complexes” d’origine temporale ou frontale le plus souvent.Il y a beaucoup d’autres types de crises partielles avec des troubles de la vue, de l’audition, du langage, de la motricité, souvent sans trouble de la conscience, ce sont les “crises partielles simples”.Dans certains cas, et de façon habituelle, peut survenir une “aura” phénomène presque toujours identique pour une même personne, annonçant l’imminence de la crise ; c’en est, de fait, le début. Pouvoir la décrire contribue à préciser son origine.Un certain nombre de crises comportent une chute plus ou moins brutale, soit avec hypertonie (raideur), soit avec hypotonie.D’autres crises encore comportent des secousses musculaires très brèves, ce sont les « secousses myocloniques ou myoclonies » dont le sujet est bien conscient.
COMMENT SONT DÉFINIES LES ÉPILEPSIES ?
Les épilepsies sont définies par plusieurs critères sur lesquels seront apportés des précisions concernant ;
· Leur cause : elles seront alors dites idiopathiques, symptomatiques ou cryptogéniques ;
· Leur localisation: crises généralisées, partielles, ou à la fois partielles et généralisées ;
· L’âge d’apparition : nouveau-né, nourrisson,. enfant, adolescent, adulte, personne âgée ;
· Leur évolution : bénigne ou sévère ;
· Leur association à d’autres maladies, souvent plus importantes ;
· Leur regroupement en syndromes, surtout chez l’enfant et l’adolescent ; ce qui permet alors de faire un pronostic, mais toutes les épilepsies ne correspondent pas à un syndrome défini...
QUELS EXAMENS SERONT DEMANDÉS ?
Il faut d’abord s’assurer qu’il s’agit bien d’une épilepsie et en rechercher la cause éventuelle. Comme cela a déjà été souligné, un examen clinique et la description des crises par l’entourage ou par le patient lui-même sont indispensables au préalable.Il fait éliminer les crises ou malaises qui peuvent ressembler à une épilepsie mais qui n’en sont pas :
malaises vagaux, spasmes du sanglot, syncopes, tétanie, spasmophilie... avec les examens adaptés.
Pour affirmer une épilepsie il faudra toujours s’appuyer sur :
1/ L’électroencéphalogramme (EEG) : réalisé dans les meilleures conditions
possibles, il permettra de mettre en évidence des anomalies intercritiques (visibles entre les crises) et, parfois, d’enregistrer les crises. L’idéal est de coupler l’EEG avec un enregistrement vidéo. Par contre, un EEG normal ne permet pas d’éliminer formellement le diagnostic d’épilepsie ; il faudra alors le renouveler. Dans certains cas, l’enregistrement pendant le sommeil est indispensable (nourrisson, jeune enfant, crises liées au sommeil ou à l’endormissement...).
Lorsque c’est nécessaire, on peut être amené à réaliser un enregistrement de longue durée, incluant tout le sommeil.Quand une épilepsie est sévère, il faut parfois réaliser un enregistrement de longue durée couplé à la vidéo sur un ou plusieurs jours, en centre spécialisé.
2/ Les examens neuroradiologiques ne sont pas toujours indispensables, par
exemple s’il s’agit d’une épilepsie idiopathique. Par contre, si l’on recherche une lésion, une IRM(Imagerie par Résonance Magnétique) pourra montrer des anomalies que la simple radiographie ou le scanner X ne peuvent pas déceler.
D’autres techniques d’imagerie peuvent être propo-sées, essentiellement si l’on envisage une possibilité chirurgicale.